Гелий неон аргон криптон ксенон радон что это
Ине́ртные или благоро́дные газы — химические элементы главной подгруппы VIII группы, у которых s- и p- оболочки полностью заполнены. К ним относятся:
Инертные газы отличаются крайне низкой химической активностью (отсюда и название). Тем не менее, все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее "инертны" неон и гелий: чтобы заставить их вступить в реакцию, нужно очень постараться, искусственно ионизируя каждый атом. Ксенон же наоборот слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8).
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах.
Инертные газы не ядовиты. Тем не менее, в атмосфере чистого инертного газа человек жить не может из-за отсутствия кислорода. Известны случаи гибели людей при утечках аргона. Вдыхание радиоактивного радона может вызвать рак.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Инертный газ" в других словарях:
Инертный газ — газ (азот), предназначенный для продувки технологического оборудования перед первоначальным заполнением системы, ремонтами и т.д. Источник … Словарь-справочник терминов нормативно-технической документации
ИНЕРТНЫЙ ГАЗ — ИНЕРТНЫЙ ГАЗ, см. БЛАГОРОДНЫЙ ГАЗ … Научно-технический энциклопедический словарь
инертный газ — Газ (азот), предназначенный для продувки технологического оборудования перед первоначальным заполнением системы, ремонтами и т.д. [ПБ 08 624 03 Правила безопасности в нефтяной и газовой промышленности, утверждены постановлением Госгортехнадзора… … Справочник технического переводчика
Инертный газ — Inert gas Инертный газ. (1) Газ типа гелия, аргона или азота, который является устойчивым, не поддерживает горение и не образует продуктов реакции с другими материалами. (2) В сварке газ, который не соединяется химически с основным или… … Словарь металлургических терминов
инертный газ — inertinės dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujinės būsenos inertiniai elementai He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inactive gas; inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
инертный газ — inertinės dujos statusas T sritis chemija apibrėžtis He, Ne, Ar, Kr, Xe, Rn. atitikmenys: angl. inert elements; inert gas; noble gas; rare gas rus. благородный газ; инертные элементы; инертный газ ryšiai: sinonimas – inertiniai elementai … Chemijos terminų aiškinamasis žodynas
инертный газ — inertinės dujos statusas T sritis fizika atitikmenys: angl. inert gas; noble gas; rare gas vok. Edelgas, n; inertes Gas, n; Inertgas, n rus. благородный газ, m; инертный газ, m pranc. gaz inerte, m; gaz noble, m; gaz rare, m … Fizikos terminų žodynas
инертный газ (металлургия) — инертный газ 1. Газ типа гелия, аргона или азота, который является устойчивым, не поддерживает горение и не образует продуктов реакции с другими материалами. 2. В сварке газ, который не соединяется химически с основным или присадочным металлом.… … Справочник технического переводчика
химически инертный газ — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN reactionless gas … Справочник технического переводчика
газ-носитель — Газообразное или парообразное вещество, движущееся через слой сорбента с целью транспортирования определяемых веществ. [ГОСТ 17567 81] газ носитель Инертный газ, используемый для транспортировки других элементов в технологический канал или в… … Справочник технического переводчика

Благородных газов в природе всего 6: Неон, Криптон, Аргон, Ксенон, Гелий и Радон
Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными. Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом. Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.

При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства. Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов. Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
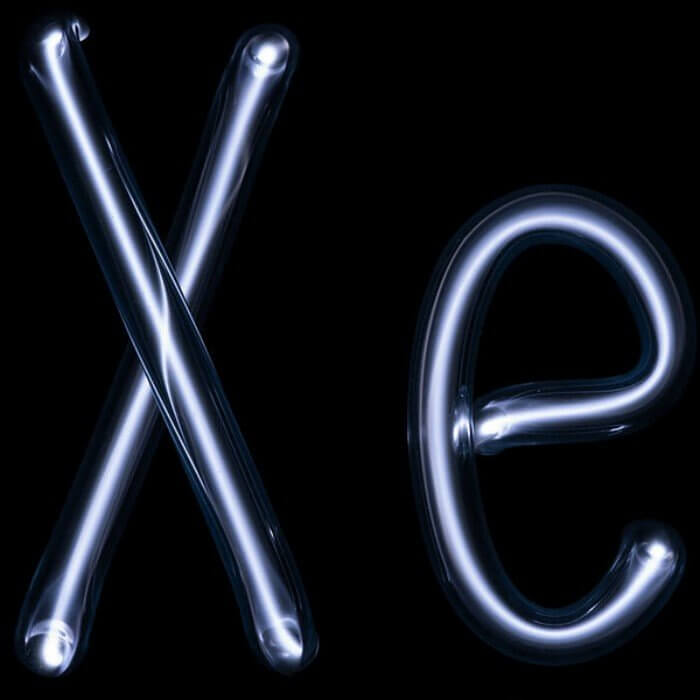
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами. Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания. Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Если вам нравится данная статья, приглашаю вас присоединиться к нашему каналу на Яндекс.Дзен, где вы сможете найти еще больше полезной информации из мира популярной науки и техники.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья. Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям. Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.

Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Где применяются благородные газы?
Самыми применяемыми человеком инертными газами считаются аргон, гелий и неон, которые используются повсеместно от физики до медицины. Так, гелий используется при сварке металлов и в качестве хладоносителя при проведении лабораторных экспериментов. Неон и аргон часто применяются при изготовлении ламп накаливания и в металлургии, при изготовлении алюминиевых сплавов.

Благодаря своим уникальным свойствам, благородные газы нашли свое применение в разных отраслях науки
Остальные благородные газы чаще всего используются в медицине. Как уже упоминалось выше, радон находит свое применение в медицине, а ксенон и криптон используются в качестве наполнителя осветительных ламп.
На нашей планете благородные газы преимущественно содержатся в воздухе, но они есть в небольших количествах в воде, горных породах, природных газах и нефти.
Много гелия в космическом пространстве, это второй по распространенности элемент после водорода. В Солнце его почти 10%. Судя по имеющимся данным, благородных газов много в атмосферах крупных планет Солнечной системы.
Все газы, кроме гелия и радона, добывают из сжиженного воздуха фракционным разделением. Гелий получают как сопутствующий продукт при добыче природного газа.
Свойства
Газы без цвета, запаха и вкуса. Они всегда есть в атмосферном воздухе, но их невозможно увидеть или почувствовать. Плохо растворяются в воде. Не горят и не поддерживают горение. Плохо проводят тепло. Хорошо проводят ток и при этом светятся. Практически не реагируют с металлами, кислородом, кислотами, щелочами, органическими веществами. Химическая активность растет по мере увеличения атомной массы.
Инертные газы не ядовиты, но способны вытеснять кислород из воздуха, понижая его концентрацию до смертельно низкого уровня.
Смеси тяжелых благородных газов с кислородом оказывают на человека наркотическое воздействие, поэтому при работе с ними следует использовать средства защиты и строго следить за составом воздуха в помещении.
Хранят газы в баллонах, вдали от источников пламени и горючих материалов, в хорошо проветриваемых помещениях. При транспортировке баллоны следует хорошо укрепить, чтобы они не бились друг о друга.
Применение
- В газовой и газово-дуговой сварке в металлургии, строительстве, автостроении, машиностроении, коммунальной сфере и пр. Для получения сверхчистых металлов.
- Нерадиоактивные благородные газы применяются в цветных газоразрядных трубках, часто используемых в уличных вывесках и рекламе, а также в лампах дневного света и лампах для загара.
Гелий

- Жидкий гелий — самая холодная жидкость на планете (кипит при +4,2 °К), востребована для исследований при сверхнизких температурах, для создания эффекта сверхпроводимости в электромагнитах, например, ядерных ускорителей, аппаратов МРТ (магнитно-резонансной томографии).
- Гелий-газ применяют в смесях для дыхания в аквалангах. Он не вызывает наркотического отравления на больших глубинах и кессонной болезни при подъеме на поверхность.
- Так как он значительно легче воздуха, им заполняют дирижабли, воздушные шары, зонды. К тому же он не горит и гораздо безопаснее ранее использовавшегося водорода.
- Гелий отличается высокой проницаемостью — на этом свойстве основаны приборы поиска течи в системах, работающих при низком или высоком давлении.
- Смесь гелия с кислородом применяется в медицине для лечения болезней органов дыхания.
ИНЕРТНЫЕ ГАЗЫ
ГРУППА 0. БЛАГОРОДНЫЕ (ИНЕРТНЫЕ) ГАЗЫ ГЕЛИЙ, НЕОН, АРГОН, КРИПТОН, КСЕНОН, РАДОН
Атомы элементов нулевой группы имеют полностью завершенную внешнюю электронную оболочку, что соответствует наиболее стабильной электронной конфигурации, и в течение многих лет считалось, что эти элементы не образуют химических соединений. Поэтому рассматриваемое семейство называли "инертные газы". Однако в 1962 в Университете Британской Колумбии (Канада) был синтезирован гексафтороплатинат ксенона Xe2PtF6. Позже были синтезированы другие соединения ксенона, а также криптона и радона. Молекулы благородных газов одноатомны в отличие от большинства распространенных газов, содержащихся в атмосфере (азот, кислород), и водорода, молекулы которых двухатомны. Благородные газы имеют очень низкие температуры сжижения и затвердевания (табл. 1) при нормальном давлении. Например, для гелия, самого легкого элемента, эти температуры находятся вблизи абсолютного нуля (0 K = 273,16° C). Также очень малы температурные области существования этих газов в жидком состоянии (разность температур кипения и плавления) и значения энергий перехода твердое состояние жидкость газ. Эти данные свидетельствуют об очень слабом межмолекулярном взаимодействии (вандерваальсовы силы очень малы), поэтому благородные газы максимально близки к состоянию идеальных газов и для них наиболее строго соблюдаются фундаментальные газовые законы (закон Бойля и др.). В случае сильной ионизации (например, в сильном магнитном поле или искровом разряде в неоновых трубках) электроны атомов этих газов могут вылетать, образуя заряженные частицы (см. энергию ионизации в табл. 1). В этих условиях затраты энергии велики.
Гелий. Гелий был открыт в 1868 при изучении солнечного затмения. При спектроскопическом анализе солнечной хроносферы была обнаружена желтая спектральная линия, первоначально отнесенная к спектру натрия, однако в 1871 Н.Локьер и Ж.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Э.Франкленд назвал новый элемент гелием от греческого слова "гелиос", означающего "солнце". В 1895 У.Рамзай выделил и идентифицировал гелий из минерала клевеита и доказал, что спектральные линии газа, выделяющегося из этого минерала, идентифицируются с линиями, наблюдаемыми при спектральном исследовании хромосферы солнца. Гелий получают в настоящее время в больших количествах из некоторых скважин природного газа в США. Особенно богатые выходы (до 8% гелия) находятся вблизи Декстера (шт. Канзас). Выделение гелия из природных газов нефтяных месторождений возможно методом фракционного охлаждения.
Гелий обладает рядом необычных физических свойств. Например, при свободном расширении гелий нагревается вместо охлаждения, характерного для большинства газов. При Ј 40 K (233,15° C) термический эффект расширения становится нормальным. При 3 K (270,15° C) образуется необычная форма жидкого гелия гелий II, обладающий сверхтекучестью свойством подниматься по стенкам сосуда и перетекать, а также необычно высокой проводимостью и малой вязкостью.
Применение. Гелий находит многочисленные применения. Поскольку он значительно легче воздуха, то используется в воздухоплавательных аппаратах. Самый легкий газ это водород (мол. масса 2,016), который легче гелия, но способен взрываться в смеси с воздухом, тогда как гелий инертен и поэтому предпочтительнее для наполнения воздушных шаров. Шар, заполненный гелием, должен быть в объеме всего на 8% больше, чем водородный шар, чтобы поднять такой же груз. Гелий, как и другие инертные газы, применяют для создания инертной среды в химических процессах (например, для предотвращения реакций с воздухом или кислородом). Сварка магния, алюминия и титана, а также специальных стальных сплавов проводится в гелиевой среде. В кислородную смесь для водолазов часто добавляют гелий вместо азота, т.к. такая смесь исключает проблемы, связанные с декомпрессионной болезнью (растворимость гелия в крови меньше, чем азота, что уменьшает время декомпрессии и соответственно болезненные ощущения). Жидкий гелий обеспечивает возможность охлаждать вещества до температур, близких к абсолютному нулю; при таких температурах часто обнаруживаются необычные свойства вещества.
Реакции образования. Наиболее общей формой гелия является изотоп 42He, называемый гелий-4. (Нижняя цифра перед символом элемента обозначает атомный номер, т.е. заряд ядра, а верхняя цифра массовое число изотопа, или общее число протонов и нейтронов, в данном случае 2 протона и 2 нейтрона.) Гелий 42He получается из a-частицы, состоящей из 2 протонов и 2 нейтронов, при присоединении 2 электронов, а a-частица является продуктом распада радиоактивного материала. Другой изотоп гелия 32He (2 протона и 1 нейтрон) стабилен, но его содержание составляет всего 14 атомов на 10 000 атомов гелия-4. Он образуется в результате космических превращений, например при бомбардировке дейтерия 21H космическими лучами получается нестабильный тритий 31H, который, испуская b-частицу, образует 32He.
См. также ГЕЛИЙ.
Неон впервые был выделен У.Рамзаем и М.Траверсом в 1898 при фракционном разделении воздуха. Из 44 т жидкого воздуха можно получить всего около 450 г неона. В газоразрядной трубке возбужденный неон имеет приятный красно-оранжевый или розовый цвет. Существенные количества неона используются в неоновой рекламе. При смешении неона с парами ртути можно получать различную окраску.
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Криптон был открыт У. Рамзаем и М. Траверсом в 1898 при анализе остатков воздуха после разделения. Необычное свойство газа заключается в возможности создания при его возбуждении интенсивной вспышки, длящейся только 0,00002 с. Поэтому его используют для высокоскоростной фотографии.
Ксенон и радон. Ксенон, тяжелый благородный газ со стабильным ядром, был открыт У.Рамзаем и М.Траверсом в 1898. Радон, самый тяжелый из благородных газов, был открыт в 1900 Э.Резерфордом (220Rn) и Ф.Дорном и А.Дебьерном (222Rn), а в 1903 Ф.Гизель и Дебьерн открыли 219Rn. Атом радона имеет три короткоживущих изотопа 222, 220 и 219 и отличается чрезвычайно нестабильной структурой ядра; он испускает a-частицы, образуя полоний. Радий распадается до радона, и поэтому все минералы, содержащие радий, содержат радон. Для выделения радона из таких минералов требуется сильное нагревание. Радон из радия собирают в ловушки и размещают в золотых ампулах для лечения больных раком. g-Излучение радона идентично излучению радия, и раковые больные получают лечение с помощью ампулы, вшитой в участок тела вблизи злокачественной опухоли.
ВОДОРОД
Водород наиболее распространенный элемент во Вселенной. Он соcтавляет большую часть вещества звезд и межзвездной материи. С кислородом он образует наиболее распространенное на земле вещество воду, а совместно с углеродом входит в состав каждого органического соединения. Водород самый легкий элемент с атомным номером 1; ядро протия наиболее стабильного изотопа водорода состоит только из одного протона без нейтронов. Всего у водорода три изотопа: 1) наиболее распространенный протий 11H, 2) дейтерий 21H (или 21D) часто называют "тяжелый" водород, 3) наименее распространенный изотоп тритий 31H (или 31T) является радиоактивным и поэтому в природе не встречается в сколько-нибудь значительном количестве. Водород бесцветный газ, без запаха, легко возгорается при комнатной температуре, плохо растворяется в воде. Он находит широкое применение в промышленности, например при гидрогенизации жиров и масел. Водород занимает особое положение в периодической системе (см. рис. 1), так как его электронная структура состоит всего из одного электрона. Способность отдавать его, образуя ионную связь, роднит водород со щелочными металлами, и его располагают в верху подгруппы щелочных металлов (подгруппа IА). Но водород может и принимать один электрон, проявляя отрицательную степень окисления, как галогены (фтор, хлор и др.), поэтому его иногда называют "псевдогалоген" и размещают в верху подгруппы галогенов (подгруппа VIIA). См. также ВОДОРОД.
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "ИНЕРТНЫЕ ГАЗЫ" в других словарях:
Инертные газы — (a. inert gasses; н. Inertgase, Tragergase; ф. gaz inertes; и. gases inertes) благородные, редкие газы одноатомные газы без цвета и запаха: гелий (Не), неон (Ne) … Геологическая энциклопедия
ИНЕРТНЫЕ ГАЗЫ — (благородные газы, редкие газы) элементы гл. подгруппы VIII группы периодич. системы элементов. К И. г. относится гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе) и радиоакт. радон (Rn). В природе И. г. присутствуют в атмосфере, Не… … Физическая энциклопедия
ИНЕРТНЫЕ ГАЗЫ — то же, что благородные газы … Большой Энциклопедический словарь
Инертные газы — то же, что благородные газы … Российская энциклопедия по охране труда
Инертные газы — ИНЕРТНЫЕ ГАЗЫ, то же, что благородные газы. … Иллюстрированный энциклопедический словарь
Инертные газы — ИНЕРТНЫЙ [нэ], ая, ое; тен, тна. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
инертные газы — Элементы VIII группы Периодич. системы: Не, Ne, Ar, Kr, Хе, Rn. И. г. отличаются хим. инертностью, что объясняется устойчивой внешн. эл нной оболочкой, на к рой у Не находится 2 эл на, у остальных по 8 эл нов. И. г. отличаются высоким потенциалом … Справочник технического переводчика
Инертные газы — Группа → 18 ↓ Период 1 2 Гелий … Википедия
инертные газы — [inert gases] элементы VIII группы Периодической системы: Не, Ne, Ar, Kr, Хе, Rn. Инертные газы отличаются химической инертностью, что объясняется устойчивой внешней электронной оболочкой, на которой у Не находится 2 электрона, у остальных по 8… … Энциклопедический словарь по металлургии
Инертные газы — благородные газы, редкие газы, химические элементы, образующие главную подгруппу 8 й группы периодической системы Менделеева: Гелий Не (атомный номер 2), Неон Ne (10), Аргон Ar (18), Криптон Kr (36), Ксенон Xe (54) и Радон Rn (86). Из… … Большая советская энциклопедия
Содержание
Химические свойства
Физические свойства

Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти [3] [4] . Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму [6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).
Читайте также:

