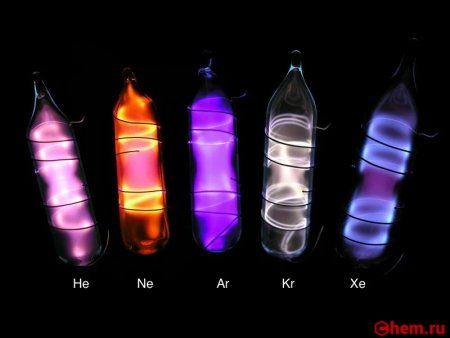
Как получают ксенон в промышленности
Ксенон — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов, с атомным номером 54. Обозначается символом Xe (Xenon). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха. Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Происхождение названия
Распространённость
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0.08 миллионной доли, хотя содержание 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Земная кора
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные изотопы ксенона, например, 133 Xe и 135 Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 467,13 нм и 462,43 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Физические свойства
Температура плавления −112 °C,температура кипения −108 °C,свечение в разряде фиолетовым цветом.
Химические свойства
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона.
Изотопы ксенона
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон. Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Применение





Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы ( 127 Xe, 133 Xe, 137 Xe, и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателейкосмических аппаратов.
- С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — как инертный газ — не вызывает химических последствий). Первые диссертации о технике ксенонового наркоза в России — 1993 г., в качестве лечебного наркоза эффективно применяется для снятия острых абстинентных состояний (Абстинентный синдром) и лечения наркомании, а также психических и соматических расстройств.
- Жидкий ксенон иногда используется как рабочая среда лазеров
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а так же в качестве компонентов газовых смесей для лазеров.
- В изотопе 129 Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния называемого гиперполяризацией.
- Ксенон используется в конструкции ячейки Голея.
Биологическая роль
Ксенон не играет никакой биологической роли.
Физиологическое действие
Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80 %) вызывает асфиксию.
Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м³.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда

Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 В Солнечной системе
- 2.2 Земная кора
- 4.1 Физические свойства
- 4.2 Химические свойства
- 4.3 Изотопы
![Ксенон]()
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли , хотя содержание изотопа 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
![Ксенон]()
При нормальном давлении температура плавления 161,40 К (−111,75 °C), температура кипения 165,051 К (−108,099 °C). Молярная энтальпия плавления 2,3 кДж/моль , молярная энтальпия испарения 12,7 кДж/моль , стандартная молярная энтропия 169,57 Дж/(моль·К) .
Плотность в газообразном состоянии при стандартных условиях (0 °C, 100 кПа ) 5,894 г/л (кг/м 3 ), в 4,9 раза тяжелее воздуха. Плотность жидкого ксенона при температуре кипения 2,942 г/см 3 . Плотность твёрдого ксенона 2,7 г/см 3 (при 133 К ), он образует кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,6197 нм , Z = 4 .
Критическая температура ксенона 289,74 К (16,59 °C), критическое давление 5,84 МПа , критическая плотность 1,099 г/см 3 .
Тройная точка: температура 161,36 К (−111,79 °C), давление 81,7 кПа , плотность 3,540 г/см 3 .
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
![Ксенон]()
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
При стандартных условиях (273 К, 100 кПа): теплопроводность 5,4 мВт/(м·К) , динамическая вязкость 21 мкПа·с , коэффициент самодиффузии 4,8·10 −6 м 2 /с , коэффициент сжимаемости 0,9950, молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К).
Ксенон диамагнитен, его магнитная восприимчивость −4,3·10 −5 . Поляризуемость 4,0·10 −3 нм 3 . Энергия ионизации 12,1298 эВ .
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
![Ксенон]()
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м 3 воздуха 9,3 л аргона и всего лишь 0,08 мл ксенона.
Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон. Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см 3 этого газа. Необычайная для того времени тонкость эксперимента!
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Свойства ксенона
Ксенон, как и все инертные газы VIII группы таблицы Менделеева, состоит из одноатомных молекул, не имеет ни запаха, ни цвета, не горит и не поддерживает горение, не взрывоопасен, слабо растворяется в воде и очень быстро выделяется из организма через легкие.
Как инертный газ он благороден, никакой биотрансформации в организме не подвергается, не вступает ни в какие химические реакции. Инертность Хе обусловлена насыщенностью внешней электронной оболочки, электронные конфигурации его предельно замкнуты и максимально прочны. Порядковый номер Хе — 54, молекулярный вес —131,29. Плотность при 0 °С и 1 Ата составляет 5,89 кг/м 3 , что в 4 раза выше, чем у воздуха и в З,2 раза выше, чем у N2О.
Ксенон в природе
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные виды ксенона, например, 133 Xe и 135 Xe , получаются как результат нейтронного облучения ядерного топлива в реакторах.
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли, хотя содержание 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Получение ксенона
Основным источником промышленного производства ксенона является воздух, где в 1000 м 3 содержится 86 см 3 ксенона. В России и странах СНГ уровень годового промышленного производства чистого ксенона составляет около 1500 м 3 .
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1–0,2% криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. Как заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон.
Основными поставщиками сырья (криптон-ксенонового концентрата) являются крупные промышленные центры металлургической промышленности России. Для получения чистого ксенона используется криптон-ксеноновый концентрат, который подвергается криогенной ректификации на газоразделительных установках, обеспечивающих получение ксенона высокой чистоты (99,999%). Из-за своей малой распространенности ксенон гораздо дороже более легких инертных газов.
Ксенон на практике
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев. Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
Радиоактивные изотопы (127 Xe , 133 Xe , 137 Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках. Фториды ксенона используют для пассивации металлов.
Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — не вызывает химических последствий — как инертный газ). Первые диссертации о технике ксенонового наркоза в России появились в 1993 г. В качестве лечебного наркоза ксенон эффективно применяется для снятия острых абстинентных состояний и лечения наркомании, а также психических и соматических расстройств.
Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
В изотопе ксенон-129 возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.
![Газ ксенон: особенности и сферы применения]()
В настоящее время инертные газы получили широкое распространение в самых различных сферах человеческой жизни. Не является исключением и газ ксенон – один из самых необычных химических элементов, известных науке. Он представляет собой так называемый благородный газ, состоящий из молекул с одним атомом, который не обладает каким-либо запахом, вкусом или цветом. Кроме того, он не горит, не приводим к взрывам и является относительно безопасным для человека.
В природе этот химический элемент представлен в крайне малых количествах. Очень незначительные запасы такого вещества сосредоточены в земной коре и атмосфере нашей планеты. Кроме того, как известно современным ученым, он занимает невысокие позиции по своей распространенности и в космосе. Возможно, именно по этой причине этот элемент долгое время оставался неизвестным науке и был открыт лишь в конце 19-го века.
Ключевой особенностью газа ксенона, которая отличает его от многих других инертных газов, является его способность вступать в химические реакции с образованием ковалентных связей. Это первый благородных газ, с помощью которого удалось получить химические соединения, например, такие как дифторид ксенона. Кроме того, он обладает и другими особенностями, которые позволяют применять его в самых различных направлениях деятельности.
Использование в источниках света
Различные виды ламп создаются с применением газообразных веществ, которые позволяют создать внутри такого изделия соответствующие условия. При создании источников света применяется и ксенон. Им наполняют некоторые виды ламп накаливания, а также высокомощные импульсные и газоразрядные лампы. Некоторые из них способны создавать по-настоящему мощное свечение, так как окруженная Xe электрическая дуга создает очень яркий свет.
![лампы для фар с ксеноном]()
Очень часто лампы с Xe применяются при создании кинопроекторов, а также софитов для концертного и театрального оборудования. Это вещество все чаще используется в качестве аналога ртути в лампах, предназначением которых является получение ультрафиолета. Еще одно его свойство заключается в том, что из-за высокой атомной массы он препятствует испарению вольфрама с поверхности нити накаливания (находясь внутри колбы лампы).
![ксеноновые фары]()
Применение в области медицины
В конце 20-го века впервые были проведены испытания медицинского ксенона, которые показали, что он является безопасным и эффективным средством для наркоза и обезболивания. Это связано с тем, что при правильной концентрации такой газ является полностью безопасным для человека. Он не вступает в какие-либо химические реакции и быстро выводится из организма.
![баллоны с газом ксеноном]()
В настоящее время его активно применяют в различных странах мира. Например, с конца 90-х годов он официально разрешен для использования в качестве анестезии на территории Российской Федерации, а в середине 2000-х годов получил разрешение и в странах-членах Европейского Союза. Если вас интересует возможность применения газов и их смесей в медицине, то предлагаем вам прочесть отдельную статью, посвященную этой теме.
Как газ ксенон применяется в сфере покорения космоса?
Обладая самой высокой стабильностью среди других тяжелых инертных газов, этот химический элемент применяется в качестве рабочего тела в:
- ионных реактивных двигателях;
- плазменных реактивных двигателях.
Для этих целей его используют преимущественно в чистом виде. При этом очищенные от различных посторонних добавок благородные газы могут обладать достаточно высокой стоимостью. Узнать с чем это связано вы можете в нашем материале, посвященном теме глубокой очистки газов.
Ионные и плазменные реактивные двигатели в настоящее время используются в современных и высокомощных космических кораблях, основным назначением которых является изучение планет Солнечной системы.
Кроме того, вас может заинтересовать и другой инертный газ – криптон, прочесть о применении которого вы можете здесь.
В чем заключается сложность получения ксенона?
Во-первых, в атмосфере Земли этот элемент является очень редким, поэтому его добыча в чистом виде невозможна. Во-вторых, технология его получения очень сложная и дорогостоящая. Его добывают как побочный продукт в процессе производства жидкого кислорода, а также при искусственном разделении воздуха на кислород и азот. Ученые ищут новые способы получения Xe, которые были бы более эффективными и безопасными в плане экологии.
![свечение ксенона]()
Выводы
Xe – это инертный тяжелый газ, который обладает особыми качествами и широко применяется в различных сферах жизни, в том числе в медицине, науке и технике. Единственная сложность заключается в трудоемком процессе его получения, а, следовательно, высокой стоимости.
В лечебном деле этот газ начал применяться относительно недавно. Однако он быстро продемонстрировал врачам свои исключительные качества и сейчас пользуется у работников здравоохранения заслуженным признанием. С химической точки зрения ксенон – благородный газ. Он является одноатомным и не имеет ни запаха, ни вкуса, ни цвета. Как и многие другие инертные газы, ксенон был обнаружен учеными в ходе исследований состава воздуха. Именно так науке стали известны, например, азот и аргон, об истории открытия которых наш журнал писал ранее. Однако в случае с ксеноном это произошло значительно позже. Он был открыт лишь в самом конце девятнадцатого века английскими учеными Уильямом Рамзаем и Морисом Траверсом. Суть их опытов состояла в том, что исследователи подвергали медленному испарению жидкий воздух, а затем спектроскопическим методом исследовали его наименее летучие фракции.
![баллон с медицинским ксеноном]()
![]()
![баллоны с газом ксеноном]()
«Сама идея получения из воздуха сильного анестетика звучит сегодня фантастично! Ксенон – без преувеличения уникальный инертный газ. Наркотический эффект его в условиях обычной земной атмосферы был предсказан и экспериментально подтвержден нашим соотечественником проф. Н.В.Лазаревым. Первое клиническое применение ксенона (Хе) в качестве средства для наркоза было выполнено американскими авторами в 1951г. Последующие экспериментальные и клинические исследования показали, что ксенон оказался самым безопасным и перспективным анестетиком ХХI века. Научная разработка ксеноновой анестезии в целях внедрения ее в практическое здравоохранение началась на кафедре анестезиологии и реаниматологии РМАПО в 1990 году. Первые экспериментальные результаты на крысах, подтверждающие наркотические свойства ксенона, были получены 12 марта 1992 года, а несколько позднее полностью подтверждены клиническим аутоэкспериментом на 14 добровольцах – молодых врачах анестезиологах, которые на себе убедились в его анестезиологической эффективности.
![маска для наркоза]()
![наркоз ксеноном]()
Поэтому на практике применяются методы рециклинга выдыхаемого пациентом газа. Он бывает двух видов:
- Во-первых, это работа по так называемому закрытому конуру. То есть выдыхаемый газ вновь направляется пациенту. При видимой простоте метода он имеет существенные недостатки. Ведь человек выдыхает не только ксенон: из организма выходят углекислый газ, ацетон, метан и прочие продукты, связанные с жизнедеятельностью. Во время длительной операции они постепенно приводят к существенному загрязнению смеси.
- Поэтому, во-вторых, существует так называемый русский метод рециклинга. Он включает в себя накопление отработанного газа с последующей десорбцией его в производственных условиях. Тщательная очистка делает газ пригодным для повторного, вернее сказать, неоднократного использования. При этом такой рециклинг, по подсчетам специалистов, снижает стоимость наркоза более чем в 30 раз.
Кстати, помимо анестезиологии, ксенон находит применение и в других секторах медицины. В частности, речь идет о снятии острых абстинентных состояний (так называемой ломки), лечении наркомании, а также психических и соматических расстройств.
Читайте также: