Температура газа в цилиндре 150
1 Данная масса газа при нормальных условиях занимает объем 300 см3. Какой объем займет этот газ при температуре -73 гр С и давлении 150 кПа?
2. Объем данной массы воздуха уменьшают в 16 раз. При этом давление воздуха увеличивается в 20 раз. Начальная температура воздуха равна 300 К. Какова конечная температура воздуха?
3. Данную массу газа изобарно нагревают на 15 гр С. Объем газа при этом увеличивается на 4%. Давление газа при этом возросло на 40 кПа. Чему равна начальная температура газа?
4. Как изменится давление данной массы газа при увеличении абсолютной температуры газа в 2 раза и уменьшении концентрации в 4 раза? Почему именно так?
Термодинамика – это теория тепловых явлений, происходящих в макротелах и их системах без учета атомно-молекулярного строения тела.
Термодинамика изучает свойства термодинамической системы в состоянии термодинамического равновесия и процессы перехода этих систем из одного состояния в другое.
В теплоизолированном цилиндре под невесомым поршнем находится идеальный газ. Сообщим системе некоторое количество теплоты Q и воздействуем на поршень некоторой внешней силой F. Рассмотрим, как изменяются параметры системы
Состояние термодинамической системы характеризуется рядом физических величин, главной из которых является внутренняя энергия.

Существует два способа изменения внутренней энергии тела:
1. Теплопередача – это процесс передачи энергии от одного тела к другому без совершения работы. Виды теплопередачи:
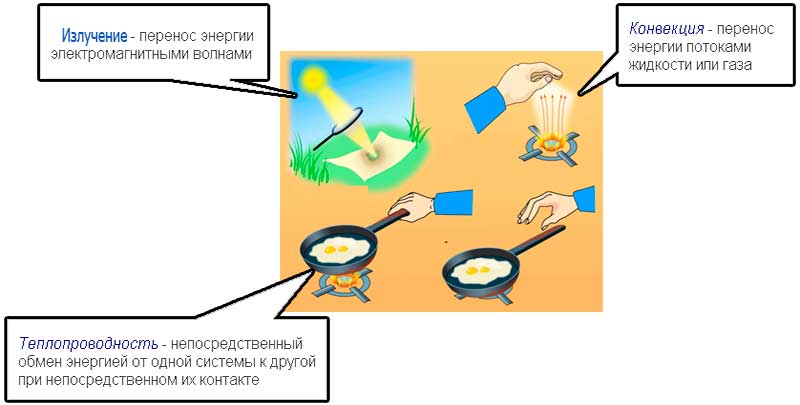
Количество теплоты, переданное при нагревании тела или выделяемое при его охлаждении:
Q=cmΔT
c – удельная теплоемкость вещества
Количество теплоты, идущее на плавление тела или выделяемое при его кристаллизации:
Q=λm
λ – удельная теплота плавления и кристаллизации тела
Количество теплоты, идущее на испарение жидкости при T=const или выделяемое при конденсации пара:
Q=Lm
L – удельная теплота парообразования и конденсации
2. Совершение механической работы
В координатах p, V работа газа равна площади фигуры под графиком зависимости давления от объема.
Изменение внутренней энергии тела (системы тел) определяется первым законом (началом) термодинамики
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
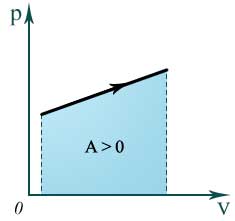
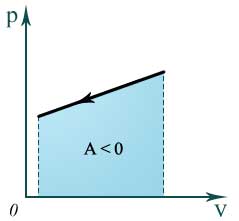
Если система сама совершает работу над внешними силами, то А=-А ‘ и первый закон термодинамики запишется так:
Изопроцессы в термодинамике
Простейшими процессами перехода термодинамической системы из одного состояния в другое являются:
Изобарный процесс p=const
Q=ΔU+A’
Изохорный процесс V=const
Q=ΔU
Газ не меняет своего объема, работа им не совершается. Т.о переданное количество теплоты идет на увеличение внутренней энергии газа.
Изотермический процесс T=const
Внутренняя энергия не меняется. Следовательно количество теплоты, переданное системе идет на совершение работы
Адиабатный процесс Q=0
A=ΔU
Процесс происходящий в системе без теплообмена с окружающей средой. При совершении работы над газом внутренняя энергия системы увеличивается, следовательно увеличивается и температура газа.

Краткие итоги:
Термодинамика – это теория тепловых явлений, происходящих в макротелах и их системах без учета атомно-молекулярного строения тел.
Термодинамика изучает свойства термодинамической системы в состоянии термодинамического равновесия и процессы перехода этих систем из одного состояния в другое.
Состояние термодинамической системы характеризуется рядом физических величин, главной из которых является внутренняя энергия. Внутреннюю энергию можно изменить в процессе теплопередачи и совершения работы. Существование двух форм изменения внутренней энергии – работы и теплообмена, отражает первый закон термодинамики, который является законом сохранения и превращения энергии применительно к тепловым процессам. Открытие этого закона в середине XIX в. связано с работами Р.Майера, Д.Джоуля и Г.Гельмгольца.
Простейшими процессами перехода термодинамической системы из одного состояния в другое является изотермический, изобарный, изохорный и адиабатный.
Термодинамика позволяет объяснить работу тепловых машин, выполнить расчеты тепловых процессов.
Задачи на применение первого закона термодинамики
1А. При изотермическом расширении идеальным газом совершена работа А = 20 кДж. Какое количество теплоты сообщено газу?
2А. Вычислите увеличение внутренней энергии кислорода массой 0,5 кг при изохорном повышении его температуры на 15 °С.
3В. Температура газа в цилиндре 150 °С, а давление 8 ∙ 10 5 Па. Газ изохорно охлаждается. Конечное давление 2 ∙ 10 5 Па. Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу. Удельная теплоемкость газа при постоянном объеме равна 0,7 ∙ 10 3 Дж/(кг ∙ К).
4В. В вертикальном цилиндре под тяжелым поршнем находится кислород массой 2 кг. Для повышения температуры кислорода на 5 К ему было сообщено количество теплоты, равное 9160 Дж. Найдите работу, совершаемую при расширении кислорода, и увеличение его внутренней энергии. Молярная масса кислорода 0,032 кг/моль.
5В. В сосуде с теплонепроницаемыми стенками объемом 5,6 л находится кислород при температуре 66 °С и давлении 0,25 МПа. Для нагревания газа до температуры 68 °С требуется сообщить газу теплоту 21 Дж. Какова удельная теплоемкость кислорода при этих условиях?
6В. В теплоизолированном цилиндре с поршнем находится азот массой 0,2 кг при температуре 20 °С. Азот, расширяясь, совершает работу 4470 Дж. Определите изменение внутренней энергии азота и его температуру после расширения. Удельная теплоемкость азота при постоянном объеме 745 Дж/ (кг ∙ К).
7В. Какое количество теплоты требуется для того, чтобы воздух массой 5 г нагреть от температуры 290 К при постоянном давлении на столько, чтобы его объем увеличился в два раза? Удельная теплоемкость воздуха при постоянном давлении 1018 Дж/(кг ∙ К).
8С. Кислород, взятый в количестве 1 моль, нагревается при постоянном объеме от температуры 0 °С. Какое количество теплоты требуется сообщить кислороду, чтобы его давление увеличилось в 3 раза? Удельная теплоемкость кислорода при постоянном объеме 657 Дж/(кг ∙ К).
9С. Для повышения температуры газа массой 20 кг и молярной массой 0,028 кг/моль на 50 К при постоянном давлении необходимо затратить количество теплоты, равное 0,5 МДж. Какое количество теплоты следует отнять от этого газа при постоянном объеме, чтобы его температура понизилась на 50 К?
10С. Давление азота, находящегося в сосуде объемом 3 л, после нагревания возросло на 2,2 МПа. Определите количество теплоты, сообщенной газу. Удельная теплоемкость азота при постоянном объеме 745 Дж/(кг ∙ К), его молярная масса 0,028 кг/моль.
. Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па?
. Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па.
Конечное давление 2 ∙ 105 Па.
Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу.
Удельная теплоемкость газа при постоянном объеме равна 0, 7 ∙ 103 Дж / (кг ∙ К).

Газ охлаждается изохорно, ⇒Δ∨ = 0⇒А’ = 0⇒Q = ΔU
P₁ / p₂ = T₁ / T₂⇒T₂ = p₂T₁ / p₁, T₁ = 150° + 273 = 423K

Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па?
Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па.
Конечное давление 2 ∙ 105 Па.
Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу.
Удельная теплоемкость газа при постоянном объеме равна 0, 7 ∙ 103 Дж / (кг ∙ К).

При изохорном охлаждении газа, взятого при температуре 207, его давление уменьшилось в 1?
При изохорном охлаждении газа, взятого при температуре 207, его давление уменьшилось в 1.
Какой стала конечная температура газа?

Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0?
Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0.
Затем объем газа возрастает изобарно.
Температура газа в начальном и конечном состояниях T1 = T3 = 300К.
Определить работу, совершенную газом.

При изохорном охлаждении идеального газа, взятого при температуре 480 К, его давление уменьшилось в 1, 5 раза?
При изохорном охлаждении идеального газа, взятого при температуре 480 К, его давление уменьшилось в 1, 5 раза.
Какой стала конечная температура газа?

Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0?
Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0.
Затем объем газа возрастает изобарно.
Температура газа в начальном и конечном состояниях T1 = T3 = 300К.
Определить работу, совершенную газом.

Чему равно количество теплоты, полученное газом от внешних тел при изохорном нагревании постоянной массы газа& ;1)Изменению внутренней энергии газа2)работе, совершенной газом3)работе, совершенной н?
Чему равно количество теплоты, полученное газом от внешних тел при изохорном нагревании постоянной массы газа& ;
1)Изменению внутренней энергии газа
2)работе, совершенной газом
3)работе, совершенной над газом
4)изменению потенциальной энергии молекул газа.

В цилиндре находится азот массой m = 24 г при температуре Т = 300 К?
В цилиндре находится азот массой m = 24 г при температуре Т = 300 К.
Газ охлаждается изохорно так, что его давление падает в n = 3 раза.
Затем газ нагревается при постоянном давлении до тех пор, пока его температура не достигает первоначальной.
Определите работу A, совершенную газом.

1 моль идеального одноатомного газа занимает объем V1 = 10 л под давлением Р1 = 100 кПа?
1 моль идеального одноатомного газа занимает объем V1 = 10 л под давлением Р1 = 100 кПа.
Нагреваясь, газ расширился при постоянном давлении до объема V2 = 30 л, после чего его давление увеличилось в 2 раза при постоянном объеме.
Определите : а) температуру газа в начальном состоянии, в конце изобарного процесса и в конце изохорного б) механическую работу, совершенную газом в) изменение внутренней энергии газа г) количество теплоты, сообщенное газу.

Под поршнем вертикального цилиндра находится m = 2 кг гелия?
Под поршнем вертикального цилиндра находится m = 2 кг гелия.
Определите : а) малярные теплоемкости гелия при постоянном давлении постоянном объеме Сv б) изменение внутренней энергии газа в) механическую работу, совершенную газом при расширении.

Идеальный газ охлаждают при постоянном давлении?
Идеальный газ охлаждают при постоянном давлении.
Начальная температура газа была равной 442 С , его конечная температура равна 2 C.
Во сколько раз уменьшился объём газа.

F = 15 * 10 ^ 3 H h = 0. 25 м A = ? = = = A = F * h = 15 * 10 ^ 3 * 0. 25 = 3. 75 * 10 ^ 3 Дж (3, 75 кДж) = = = = = = = = = = = = = = = = = = =.

4 номер кажется в силе но не точно.


Кол — теплоты на воду = 4200×13, 2×4 = 221760 Дж. Теплоемкость кирпича = 221760Дж÷(4×63) = 880Дж / кг×С Ответ : 880 Дж / КГ × С.

Дано : | U = 20В. | g = 20Кл. | t = 20с. | ________| A = ? Решение : А = U * I * t I = g / t I = 20Кл * 20с = 400А А = 20В * 400А * 20с = 160000Дж Ответ : 160000Дж.

Физическая величина, равная отношение силы, действующей перпендикулярно поверхности, к площади этой поверхности — давление. Обозначается р. Давление = сила / площадь.


W1 = CU1 ^ 2 / 2 = 10 * 10 ^ — 6 * 160000 / 2 = 5 * 16 * 10 ^ — 2 = 80 * 10 ^ — 2 = 0. 8 Дж Энергия конденсатора W2 = CU2 ^ 2 / 2 = 10 * 10 ^ — 6 * 400000 / 2 = 5 * 4 * 10 ^ — 2 = 20 * 10 ^ — 2 = 0. 2 Дж Выделилось 0, 8 — 0, 2 = 0, 6 Дж.

1 Н ( ньютон) — единица силы.

При последовательном соединение сопротивление равно суме сопротивлений резисторов 3 Ом + 6 Ом = 9 Ом.
Температура газа в цилиндре 150 с а давление 8 10
Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па. Газ изохорно охлаждается. Конечное давление 2 ∙ 105 Па. Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу. Удельная теплоемкость газа при постоянном объеме равна 0,7 ∙ 103 Дж/(кг ∙ К).
Ответы и объяснения 1
A=0 тогда из первого начала термодинамики имеем
Q=U= 0,7 ∙ 10^3*1*(105.75-423)=-222075 Дж
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
. Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па?
. Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па.
Конечное давление 2 ∙ 105 Па.
Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу.
Удельная теплоемкость газа при постоянном объеме равна 0, 7 ∙ 103 Дж / (кг ∙ К).

Газ охлаждается изохорно, ⇒Δ∨ = 0⇒А’ = 0⇒Q = ΔU
P₁ / p₂ = T₁ / T₂⇒T₂ = p₂T₁ / p₁, T₁ = 150° + 273 = 423K

Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па?
Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па.
Конечное давление 2 ∙ 105 Па.
Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу.
Удельная теплоемкость газа при постоянном объеме равна 0, 7 ∙ 103 Дж / (кг ∙ К).

При изохорном охлаждении газа, взятого при температуре 207, его давление уменьшилось в 1?
При изохорном охлаждении газа, взятого при температуре 207, его давление уменьшилось в 1.
Какой стала конечная температура газа?

Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0?
Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0.
Затем объем газа возрастает изобарно.
Температура газа в начальном и конечном состояниях T1 = T3 = 300К.
Определить работу, совершенную газом.

При изохорном охлаждении идеального газа, взятого при температуре 480 К, его давление уменьшилось в 1, 5 раза?
При изохорном охлаждении идеального газа, взятого при температуре 480 К, его давление уменьшилось в 1, 5 раза.
Какой стала конечная температура газа?

Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0?
Газ в количестве 4 моль вначале охлаждают при постоянном объеме так, что его давление уменьшается от p1 = 3p0 до p2 = p0.
Затем объем газа возрастает изобарно.
Температура газа в начальном и конечном состояниях T1 = T3 = 300К.
Определить работу, совершенную газом.

Чему равно количество теплоты, полученное газом от внешних тел при изохорном нагревании постоянной массы газа& ;1)Изменению внутренней энергии газа2)работе, совершенной газом3)работе, совершенной н?
Чему равно количество теплоты, полученное газом от внешних тел при изохорном нагревании постоянной массы газа& ;
1)Изменению внутренней энергии газа
2)работе, совершенной газом
3)работе, совершенной над газом
4)изменению потенциальной энергии молекул газа.

В цилиндре находится азот массой m = 24 г при температуре Т = 300 К?
В цилиндре находится азот массой m = 24 г при температуре Т = 300 К.
Газ охлаждается изохорно так, что его давление падает в n = 3 раза.
Затем газ нагревается при постоянном давлении до тех пор, пока его температура не достигает первоначальной.
Определите работу A, совершенную газом.

1 моль идеального одноатомного газа занимает объем V1 = 10 л под давлением Р1 = 100 кПа?
1 моль идеального одноатомного газа занимает объем V1 = 10 л под давлением Р1 = 100 кПа.
Нагреваясь, газ расширился при постоянном давлении до объема V2 = 30 л, после чего его давление увеличилось в 2 раза при постоянном объеме.
Определите : а) температуру газа в начальном состоянии, в конце изобарного процесса и в конце изохорного б) механическую работу, совершенную газом в) изменение внутренней энергии газа г) количество теплоты, сообщенное газу.

Под поршнем вертикального цилиндра находится m = 2 кг гелия?
Под поршнем вертикального цилиндра находится m = 2 кг гелия.
Определите : а) малярные теплоемкости гелия при постоянном давлении постоянном объеме Сv б) изменение внутренней энергии газа в) механическую работу, совершенную газом при расширении.

Идеальный газ охлаждают при постоянном давлении?
Идеальный газ охлаждают при постоянном давлении.
Начальная температура газа была равной 442 С , его конечная температура равна 2 C.
Во сколько раз уменьшился объём газа.

F = 15 * 10 ^ 3 H h = 0. 25 м A = ? = = = A = F * h = 15 * 10 ^ 3 * 0. 25 = 3. 75 * 10 ^ 3 Дж (3, 75 кДж) = = = = = = = = = = = = = = = = = = =.

4 номер кажется в силе но не точно.


Кол — теплоты на воду = 4200×13, 2×4 = 221760 Дж. Теплоемкость кирпича = 221760Дж÷(4×63) = 880Дж / кг×С Ответ : 880 Дж / КГ × С.

Дано : | U = 20В. | g = 20Кл. | t = 20с. | ________| A = ? Решение : А = U * I * t I = g / t I = 20Кл * 20с = 400А А = 20В * 400А * 20с = 160000Дж Ответ : 160000Дж.

Физическая величина, равная отношение силы, действующей перпендикулярно поверхности, к площади этой поверхности — давление. Обозначается р. Давление = сила / площадь.


W1 = CU1 ^ 2 / 2 = 10 * 10 ^ — 6 * 160000 / 2 = 5 * 16 * 10 ^ — 2 = 80 * 10 ^ — 2 = 0. 8 Дж Энергия конденсатора W2 = CU2 ^ 2 / 2 = 10 * 10 ^ — 6 * 400000 / 2 = 5 * 4 * 10 ^ — 2 = 20 * 10 ^ — 2 = 0. 2 Дж Выделилось 0, 8 — 0, 2 = 0, 6 Дж.

1 Н ( ньютон) — единица силы.

При последовательном соединение сопротивление равно суме сопротивлений резисторов 3 Ом + 6 Ом = 9 Ом.
Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па. Газ изохорно охлаждается. Конечное давление 2 ∙ 105 Па. Найдите изменение внутренней энергиигаза массой 1 кг, его конечную температуру и совершенную работу. Удельная теплоемкость газа при постоянном объеме равна 0,7 ∙ 103 Дж/ (кг ∙ К).

T1=423 Kp1=8*10^5 Паp2=2*10^5 Паp1/T1=P2/T2T2=(p2*T1) /p1T2=(2*10^5*423) / (8*10^5)=105,75 KПри изохорном процесе A=0 тогда из первого начала термодинамики имеем Q=U=cm (T2-T1) Q=U=0,7 ∙ 10^3*1*(105,75-423)=-222075 Дж

Первый закон, или первое начало термодинамики является частным случаем закона сохранения энергии. Разберемся, как он работает, с помощью решения простых задач. Кстати, у нас есть и примеры решения задач на второе начало термодинамики.
Подписывайтесь на наш телеграм-канал, чтобы не только легко решать задачи, но и узнавать лайфхаки для любых жизненных ситуаций.
Первый закон термодинамики: решение задач
Алгоритм решения задач на первый закон термодинамики ничем не отличается от алгоритма решения любой другой физической задачи. С ним вы можете ознакомиться, открыв нашу универсальную памятку. Также полезно будет держать под рукой формулы, которые часто используются при решении задач.
Задача №1. Применение первого закона термодинамики
Условие
Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели, сообщив ему количество теплоты в 1,5*10^5 Дж, поршень сдвинулся на расстояние h=30 см. Как изменилась внутренняя энергия газа, если его давление осталось равным 2*10^7 Па.
Решение
Запишем первое начало термодинамики:
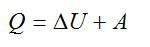
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
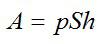
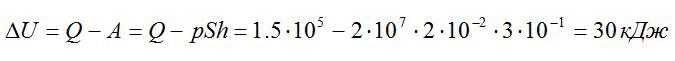
Ответ: 30 кДж.
Задача №2. Применение первого закона термодинамики
Условие
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Решение
Записываем первое начало термодинамики и подставляем значения:
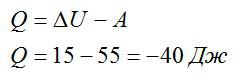
Ответ: в процессе газ отдал 40 Дж теплоты.
Задача №3. Расчет работы, изменения внутренней энергии и количества теплоты
Условие
Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров. Определить изменение внутренней энергии кислорода, работу, совершенную газом, и количество теплоты, сообщенное ему.
Решение
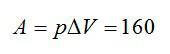
Изменение внутренней энергии равно:
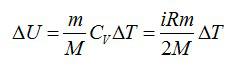
Используем уравнение состояния газа:
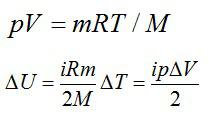
Число степеней свободы i для двухатомной молекулы равно 5.
Согласно первому закону термодинамики, сообщенное газу тепло равно:
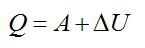
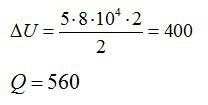
Ответ: А=160 кДж, ∆U=400 кДж, Q=560 кДж.
Задача №4. Изопроцессы
Условие
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Решение
Так как нагревание газа происходит при постоянном объеме, процесс – изохорный. При изохорном процессе:
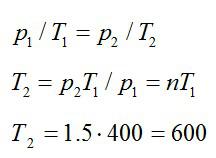
Ответ: 600 К.
Задача №5. Расчет изменения энтропии
Условие
Найти изменение ∆S энтропии при расширении массы m = 6 г гелия от объема V1 = 20 л под давлением р1 = 150 кПа к объему V2 = 60 л под давлением р2 = 100 кПа.
Решение
Изменение энтропии при переходе вещества из состояния 1 в состояние 2:
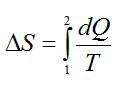
Согласно первому началу термодинамики:
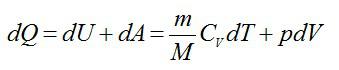
Из уравнения Менделеева-Клапейрона выразим давление:
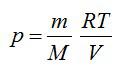
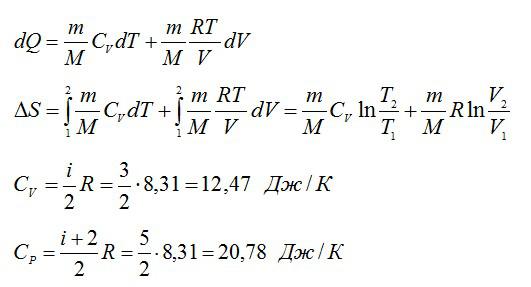
Из уравнения Менделеева-Клапейрона:
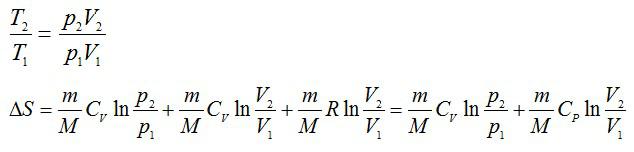
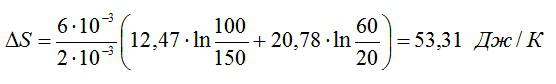
Ответ: ∆S=53,31 Дж/К.
Кстати! Для наших читателей действует скидка 10% на любой вид работы.
Вопрос 1. Приведите пример действия первого закона термодинамики.
Ответ. В качестве примера можно привести газ в сосуде. Если сообщить ему какое-то количество теплоты, оно пойдет на увеличение внутренней энергии газа в сосуде.
Вопрос 2. Сформулируйте первый закон термодинамики.
Ответ. В любой изолированной системе запас энергии остается постоянным.
Вопрос 3. Как еще можно сформулировать первый закон термодинамики?
Ответ. Вот разные формулировки первого закона термодинамики:
- Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
- Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Вопрос 4. Что такое изопроцесс? Какие есть изопроцессы?
Ответ. По определению:
Изопроцесс – это термодинамический процесс, при котором один из параметров системы (давление, объем, температура, энтропия) остается неизменным.
Изопроцесс может быть:
- изотермическим (T=const);
- изобарным (P=const);
- изохорным (V=const);
- Адиабатическим (отсутствует теплообмен с окружающей средой).
Вопрос 5. При каком изопроцессе газ не совершает работу?
Ответ. При изохорном.
Ищете, где почитать теорию по теме, а учебника нет под рукой? Далеко ходить на надо, почитайте наш отдельный материал по первому началу термодинамики. А если при решении заданий понадобится помощь, обращайтесь в профессиональный студенческий сервис.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Читайте также:

