Составьте формулы следующих соединений фтора с ксеноном бериллия с углеродом
Тетрафторметан — бинарное химическое соединение. Химическая формула — CF4. Синонимы: четырёхфтористый углерод, тетрафторид углерода, фреон 14, хладон 14.
Тетрафторметан является самым простым из фторуглеродов. Oбладает высокой химической стойкостью. Из-за большого количества связей углерод-фтор и высокой электроотрицательности фтора атом углерода в этом соединении имеет значительный положительный заряд, что укрепляет и укорачивает связь углерод-фтор. Тетрафторметан является парниковым газом [источник не указан 991 день] .
Содержание
Свойства
Физические
При комнатной температуре представляет собой химически инертный, бесцветный газ без запаха.
Свойства соединения
Тетрафторметан является одним из самых стабильных соединений в органической химии. Из фторпроизводных метана, представленных фторметаном, дифторметаном, трифторметаном и тетрафторметаном, связь фтора и углерода в тетрафторметане является самой прочной.
Получение
Чистый тетрафторметан был впервые синтезирован в 1926 году [1] . Тетрафторметан может быть получен в лабораторных условиях при реакции карбида кремния с фтором:

Она также может быть получен фторированием двуокиси углерода, окиси углерода или фосгена с помощью тетрафторида серы. Коммерчески он производится реакцией фтора с дихлордифторметаном или хлортрифторметаном; также — в ходе электролиза фторидов металла MF, MF2 с помощью угольного электрода.
Тетрафторметан, как и другие фторуглероды, весьма устойчив благодаря связи фтор—углерод. Энергия связи в этом соединении равна 515 кДж/моль. В результате этого он инертен по отношению к кислотам и гидроксидам. Тем не менее, он реагирует со взрывом с щелочными металлами. При контакте тетрафторметана с пламенем получаются токсичные газы (например карбонилфторид или окись углерода); в присутствии воды получается фтороводород.
Синтез
Также можно получить данное вещество из углекислого газа, угарного газа или фосгена фторированием тетрафторидом серы:

При температуре в 350—375 °C углерод в форме графита реагирует с трифторидом азота:

Самым простым способом получения является реакция при температуре выше 900 °C углерода с фтором:

Использование
- Тетрафторметан иногда в качестве низкотемпературного хладагента (фреон 14, хладон 14).
- В микроэлектронике, отдельно, или в сочетании с кислородом как плазменный протравливатель на кремнии, диоксиде кремния или нитрида кремния.
- Компонент дыхательных смесей при глубоководных погружениях.
- В системах автоматического пожаротушения.
- Стабилизатор разложения озона.
- Разбавитель при проведении химических реакций. для получения фторорганических продуктов.
Воздействие на окружающую среду
Тетрафторметан является сильным парниковым газом, который способствует парниковому эффекту. Это очень стабильное соединение, время его распада составляет примерно 50 000 лет, в то время как самая высокая отметка ПГП составляет 6500 лет (главным парниковым газом является CO2).
Тетрафторметан схож по строению с хлорфторуглеродом (ХФУ), но в отличие от него тетрафторметан не разрушает озоновый слой. Это происходит потому, что с озоном взаимодействуют атомы хлора в ХФУ, которые образуются под действием ультрафиолетового излучения.
Опасность использования
При контакте кожи с жидкостью возможно обморожение. Вдыхание тетрафторметана может привести, в зависимости от концентрации, к головной боли, помутнению сознания, тошноте, головокружению и повредить сердечно-сосудистую систему. Длительное воздействие может вызвать серьёзные повреждения сердца.
Благодаря своей плотности тетрафторметан может вытеснить воздух, что может привести к удушению в недостаточно проветриваемых помещениях.
См. также
Примечания
- ↑ Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0080379419
- Фториды
- Фторорганические соединения
- Галогензамещённые метаны
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Тетрафторид углерода" в других словарях:
Тетрафторид кремния — Тетрафторид кремния … Википедия
Тетрафторид теллура — Общие Систематическое наименование Тетрафторид теллура Традиционные названия Фтористый теллур Химическая формула TeF4 Физические свойства Состоян … Википедия
УГЛЕРОДА СЕМЕЙСТВО — ПОДГРУППА IVA. СЕМЕЙСТВО УГЛЕРОДА КРЕМНИЯ УГЛЕРОД, КРЕМНИЙ, ГЕРМАНИЙ, ОЛОВО, СВИНЕЦ Характерная для подгруппы IIIA особенность постепенного перехода от легкого неметаллического элемента к тяжелому типичному металлу наблюдается и в этой подгруппе … Энциклопедия Кольера
Список неорганических соединений по элементам — Основная статья: Неорганические соединения Список неорганических соединений по элементам информационный список неорганических соединений, представленный в алфавитном порядке (по формуле) для каждого вещества, водородные кислоты элементов (при их… … Википедия
Фтор — У этого термина существуют и другие значения, см. Фтор (значения). 9 Кислород ← Фтор → Неон … Википедия
Фторид диртути(2+) — Систематическое название Фторид диртути(2+) Другие названия Дифторид д … Википедия
Фреоны — (хладоны) техническое название группы насыщенных алифатических фторсодержащих углеводородов, применяемых в качестве хладагентов, пропеллентов, вспенивателей, растворителей. Кроме атомов фтора фреоны могут содержать атомы хлора или брома[1].… … Википедия
Тетрафторэтилен — Тетрафторэтилен … Википедия
Хлорфторуглероды — Хлорфторуглероды органические соединения, состоящие иcключительно из атомов хлора (Cl), фтора (F) и углерода (С). Различают низшие хлорфторуглероды (CFC) низкокипящие органические соединения на основе метанового, этанового и… … Википедия
Фторорганические соединения — – это галогенсодержащие соединения, содержащие хотя бы один атом фтора. В 30 х годах прошлого века для разделения изотопов UF6 возникла необходимость в устойчивых к нему смазочных материалах. Проблема была решена предоставленным Джоном Саймонсом… … Википедия
Углерод - неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец - металлы.

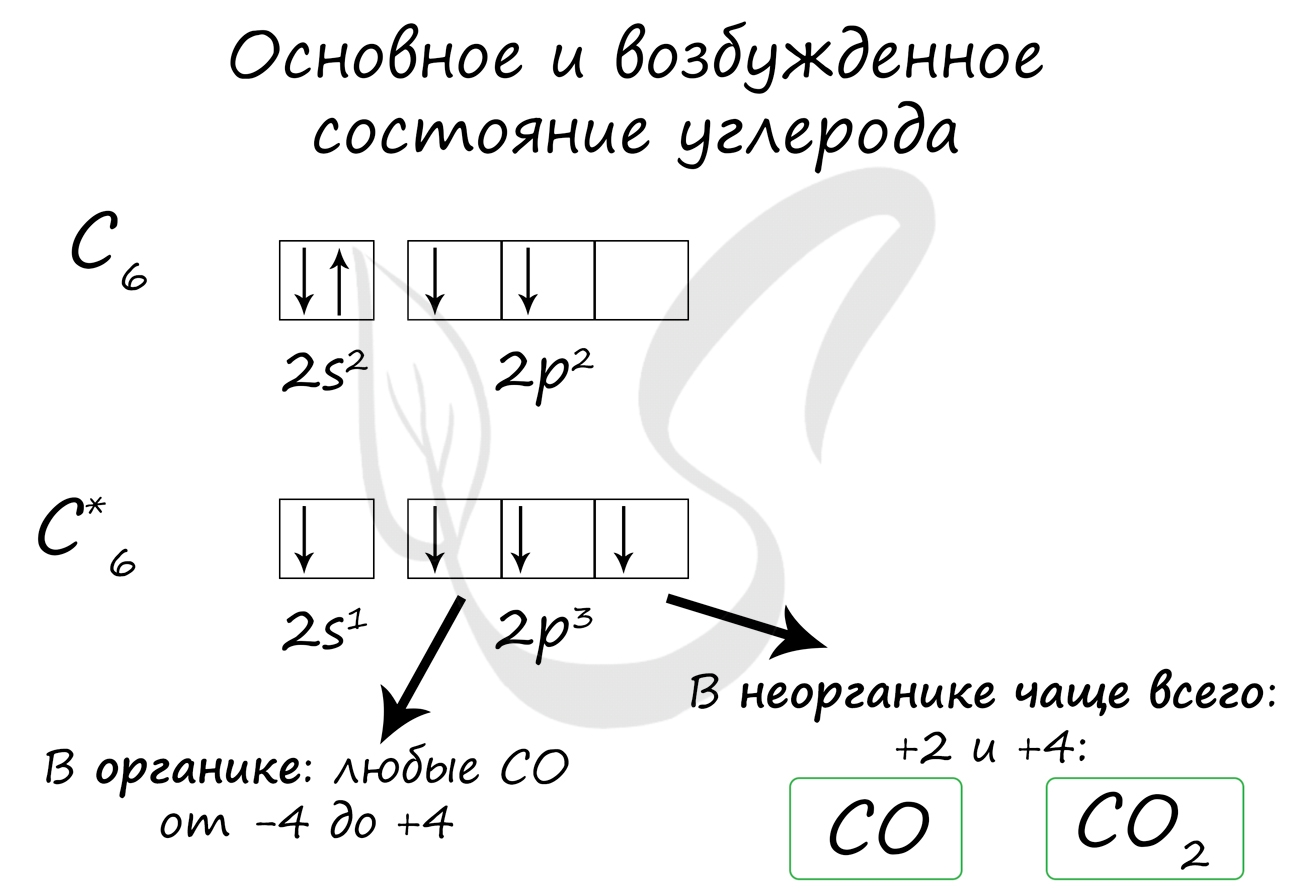
- C - 2s 2 2p 2
- Si - 3s 2 3p 2
- Ge - 4s 2 4p 2
- Sn - 5s 2 5p 2
- Pb - 6s 2 6p 2
Природные соединения
- Аллотропных модификаций - графит, алмаз, фуллерен
- MgCO3 - магнезит
- CaCO3 - кальцит (мел, мрамор)
- CaCO3*MgCO3 - доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз - нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.

Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ - продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ - продукт полного окисления углерода, образуется при достаточном количестве кислорода)
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод - хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца - крайне важна в промышленности:
В реакциях с кислотами углерод проявляет себя как восстановитель:

Оксид углерода II - СO
Оксид углерода II - продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов - чрезвычайно токсичных веществ.

Оксид углерода IV - CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:

Химические свойства
-
Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние - карбонаты (при избытке основания), кислые - гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание - кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание - кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается "закипанием" - появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа - помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.

Чтобы сделать из средней соли (карбоната) - кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 - ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты - на карбонат металла, углекислый газ и воду.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Мы старались сделать для вас лучшую статью в интернете.
Поделитесь ею с друзьями, так вы поддержите развитие проекта.
Когда вы делитесь записью, вы помогаете ресурсу расти, что стимулирует нас продолжать развивать проект и радовать вас новым профессиональным контентом.
P.S. Если вы не хотите нас поддержать, нажмите на крестик в правом нижнем углу.




Составьте формулы соединения углерода с:а) бериллием б)алюминием в) серой г) фтором Обозначьте степень окисления каждого элемента, поставив на первое место в формуле элемент с меньшей электроотрицательностью.
Ве2С и ВеС2,Al4C3,СaS,CaF2

Если вас не устраивает ответ или его нет, то попробуйте воспользоваться поиском на сайте и найти похожие ответы по предмету школьной программы: биология.
На сегодняшний день (12.01.2022) наш сайт содержит 239968 вопросов, по теме: биология. Возможно среди них вы найдете подходящий ответ на свой вопрос.
Нажимая на кнопку "Ответить на вопрос", я даю согласие на обработку персональных данных
Последние опубликованные вопросы


При использовании любых материалов
с данного сайта обязательно активная
гиперссылка на страницу-источник информации.
Все ответы на вопросы школьной программы по различным дисциплинам, а также разбор домашних заданий и многое другое получено из открытых источников или добавлены на сайт пользователями, все материалы доступны бесплатно и как есть.

Составьте уравнения реакций взаимодействия; а)натрия с серой; б)кальция с водородом; в)бария с водой; г)алюминия с раствором сульфата меди(2)(в малекулярном и ионном видах).

Запишите электронную формулу атома кальция. определите заряд ядра, число электронов, протонов, нейтронов. составьте формулу его гидроксида. характе гидроксида подтвердите уравнениями реакций



Для металлов главной подгруппы 3 группы характерно наличие на внешней электронной оболочке 1e 2e 3e4e5e

Составьте уравнения реакций в соответствии со схемой превращений: c2h4--> c2h5oh--> c2h4--> co2--> стрелкой +h2o, co2--> x укажите условия протекания реакций и назовите вещество х. !


Вычислите массу осадка который образуется при взаимодействии 100 грамм раствора содержащего 10 процентов соляной кислоты 5 моль силиката натрия

Ксмеси этана и пропана объемом 100 мл добавили 400 мл кислоты, взорвали. после конденсации паров воды и газовой смеси к исходному условиям её объем составил 240 мл. вычислите объемные доли газов в исходной смеси.


Лампочка прибора для испытания электропроводимости веществ загорится при помещении электродов в: 1 гидроксид натрия(водн. р-р) 2 воду 3 карбонат кальция 4 оксид серы (iv)
Составьте формулу соединений а) фтора с ксеноном, б) бериллия с углеродом, в которых электро положит.
Читайте также:

