Степени окисления ксенона в соединениях
Степень окисления – это количественная оценка состояния атома химического элемента в соединении, основанная на его электроотрицательности.
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Таблица степени окисления химических элементов
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br -1 4.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
№54 Ксенон
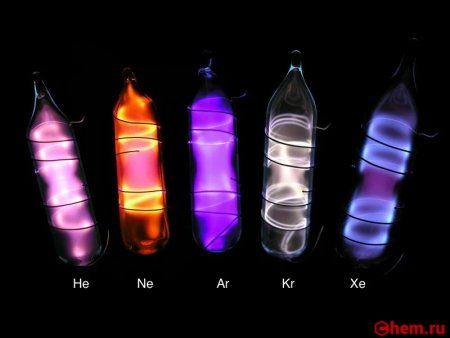
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и не удивительно: в 1 м 3 воздуха всего лишь 0,08 мл ксенона. Рамзай совместно с Траверсом переработали около 100 т жидкого воздуха и получили 0,2 мл газа, который голубовато светился в электрическом разряде и давал своеобразный спектр с характерные спектральными линиями от оранжевой до фиолетовой области. Так был открыт новый инертный газ. Его назвали, ксеноном, что в переводе с греческого значит "чужой".
Получение:
Получают ректификацией жидкого воздуха. Хотя содержание ксенона в атмосфере крайне мало, именно воздух - практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый - потому, что почти весь ксенон возвращается в атмосферу.
Физические свойства:
Ксенон представляет собой тяжелый, редкий и пассивный газ, который при значительном охлаждении может быть переведен в жидкое и твердое состояние. Как и все инертные газы он не имеет цвета и запаха. При высоком давлении способен образовывать кристаллические гидраты. Растворяется в воде и органических растворителях. Ксенон обладает сравнительно хорошей электропроводностью.
Химические свойства:
Важнейшие соединения:
Дифторид ксенона XeF2, летучие кристаллы, имеет резкий специфический запах. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Очень чистый XeF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его - сильнейший окислитель. Постепенно окисляет воду, образуя ксенон, кислород и фтористый водород; особенно быстро реакция идет в щелочной среде. Тетрафторид ксенона XeF4, вполне устойчивое соединение, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Кристаллическое вещество, во влажном воздухе взрывоопасен. Гидролизуется в воде с образованием оксида ксенона ХеО3. Тетрафторид ксенона фторирует ртуть:
XeF4 + 2Hg = Хе + 2HgF2.
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Гексафторид ксенона XeF6, крист. вещество, чрезвычайно активен и разлагается со взрывом. Гидролизуется с образованием оксофторидов и оксида ксенона(VI), с растворами щелочей диспропорционирует, образуя перксенаты. Он легко реагирует с фторидами щелочных металлов (кроме LiF), образуя соединения типа CsF*XeF6
Гексафторплатинат ксенона XePtF6 твердое оранжево-желтое вещество. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XеPtF6+6H2O = 2Xe+РtO3 + 12HF
Существует также соединение Xе[PtF6]2. Аналогичные соединения ксенон образует с гексафторидами рутения, родия и плутония.
Оксид ксенона(VI) , бесцветные, расплывающиеся на воздухе кристаллы. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Растворим, сильный окислитель.
Ксенаты соли ксеноновой кислоты - H2ХеO4, растворимы, в щелочной среде разлагаются на ксенон и перксенаты. Окислители, взрывоопасны.
Оксид ксенона(VIII) Молекула ХеО4 построена в виде тетраэдра с атомом ксенона в центре. Вещество это нестойко, при температуре выше 0°С разлагается на кислород и ксенон. Иногда разложение носит характер взрыва.
Перксенаты соли перксеноновой кислоты - H4ХеO6, кристаллич., устойчивы до 300°С, нерастворимы. Самые сильные из известных окислителей.
Применение:
В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр - от ультрафиолетового до ближней области инфракрасного. Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности.
Ксеноном пользуются и медики - при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден.
Радиоактивный изотоп элемента № 54, ксенон-133, используют при исследовании функциональной деятельности легких и сердца.
В виде фторидов ксенона удобно хранить и транспортировать и дефицитный ксенон, и всеразрушающий фтор. Соединения ксенона используются также как сильные окислители и фторирующие агенты.

Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 В Солнечной системе
- 2.2 Земная кора
- 4.1 Физические свойства
- 4.2 Химические свойства
- 4.3 Изотопы
![Ксенон]()
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли , хотя содержание изотопа 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
![Ксенон]()
При нормальном давлении температура плавления 161,40 К (−111,75 °C), температура кипения 165,051 К (−108,099 °C). Молярная энтальпия плавления 2,3 кДж/моль , молярная энтальпия испарения 12,7 кДж/моль , стандартная молярная энтропия 169,57 Дж/(моль·К) .
Плотность в газообразном состоянии при стандартных условиях (0 °C, 100 кПа ) 5,894 г/л (кг/м 3 ), в 4,9 раза тяжелее воздуха. Плотность жидкого ксенона при температуре кипения 2,942 г/см 3 . Плотность твёрдого ксенона 2,7 г/см 3 (при 133 К ), он образует кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,6197 нм , Z = 4 .
Критическая температура ксенона 289,74 К (16,59 °C), критическое давление 5,84 МПа , критическая плотность 1,099 г/см 3 .
Тройная точка: температура 161,36 К (−111,79 °C), давление 81,7 кПа , плотность 3,540 г/см 3 .
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
![Ксенон]()
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
При стандартных условиях (273 К, 100 кПа): теплопроводность 5,4 мВт/(м·К) , динамическая вязкость 21 мкПа·с , коэффициент самодиффузии 4,8·10 −6 м 2 /с , коэффициент сжимаемости 0,9950, молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К).
Ксенон диамагнитен, его магнитная восприимчивость −4,3·10 −5 . Поляризуемость 4,0·10 −3 нм 3 . Энергия ионизации 12,1298 эВ .
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
![Фторид ксенона II]()
Дифторид ксенона (Дифторид ксенона) XeF2 — твёрдое плотное кристаллическое соединение белого цвета, образованное атомами фтора и ксенона. Одно из самых устойчивых соединений ксенона.
Содержание
- 1 Физико-химические свойства
- 1.1 Термодинамические величины
- 1.2 Растворимость
- 4.1 Образование координационных соединений
- 4.2 Реакции фторирования с простыми веществами
- 4.3 Реакции окисления
- 4.4 Окислительное фторирование
- 4.5 Восстановительное фторирование
- 4.6 Фторирование ароматических соединений
- 4.7 Фторирование непредельных соединений
- 4.8 Фторирующее декарбоксилирование
Физико-химические свойства
Обладает характерным тошнотворным запахом.
В инфракрасных спектрах наблюдается чёткий дублет полос поглощения с волновыми числами 550 и 556 см −1 .
Термодинамические величины
Свойство Значение Стандартная энтальпия образования (298 К, в твёрдой фазе) −176 кДж/моль Стандартная энтальпия образования (298 К, в газовой фазе) −107,5 кДж/моль Энтальпия плавления 16,8 кДж/моль Энтальпия возгонки 50,6 кДж/моль Энтропия образования (298 К, в газовой фазе) 259,403 Дж/(моль·К) Теплоёмкость (298 К, в газовой фазе) 54,108 Дж/(моль·К) Растворимость
Растворитель Значение Жидкий аммиак Не растворим Ацетонитрил Растворим Вода (при 0 °C) 2,5 г/100 мл Диоксид серы Растворим Пентафторид иода 153,8 г/100 мл Трифторид брома Растворим Фтороводород Растворим Строение
Молекула дифторида ксенона линейная. Длины связей Xe—F равны 0,198 нм.
Получение
Впервые синтез XeF2 провёл Червик Виикс в 1962 году.
Синтез проводят из простых веществ при нагревании, ультрафиолетовом облучении или действии электрического разряда:
Продукт конденсируют при −30 °C. Очистку проводят методом фракционной дистилляции.
Механизм данной реакции достаточно интересный, и, по-видимому, в нём как-то участвуют молекулы фтороводорода, которыми обычно загрязнён газообразный фтор. Это обнаружили Шмарк и Лютар, которые для синтеза использовали неочищенный от водорода фтор, и при этом скорость реакции выросла в 4 раза по сравнению с использованием чистого фтора.
Также существует метод получения дифторида ксенона из фторида кислорода II и ксенона. Для этого смесь газов помещают в никелевый сосуд и нагревают до 300 °C под давлением:
В России налажено производство дифторида ксенона на Сибирском химическом комбинате.
Дифторид ксенона образуется также при реакции ксенона с диоксидифторидом при −120 °C.
Химические свойства
При возгонке дифторид ксенона диспропорционирует на свободный ксенон и тетрафторид ксенона:
В холодной подкисленной воде разлагается достаточно медленно, зато в щелочной среде разложение идёт быстро:
2 XeF2 + 4 NaOH → 2 Xe ↑ + 4 NaF + 2 H2O + O2 ↑
Менее активный окислитель, чем молекулярный фтор.
Образование координационных соединений
XeF2 может выступать в качестве лиганда в комплексных соединениях. Например, во фтороводородном растворе возможна следующая реакция:
Кристаллографический анализ показывает, что атом магния координирован 6 атомами фтора, 4 из которых являются мостиками между атомами магния и ксенона.
Известно множество таких реакций с продуктами типа [M x (XeF2)n](AF6)x, в которых в качестве атома M могут выступать Ca, Sr, Ba, Pb, Ag, La или Nd, а атомом A могут быть As, Sb или P.
Такие реакции требуют большого избытка дифторида ксенона.
В твердофазной системе в присутствии фторида цезия некоторые металлы (Ce, Pr, Nd, Tb, Dy, Tu) могут образовывать комплексные соединения типа Cs3[CeF7].
С пентафторидом мышьяка образуется гексафторарсенат трифтордиксенона, в котором в качестве катиона выступает молекулярный ион Xe2F3 + . Также известны соединения, где катионом является Xe2 + .
Реакции фторирования с простыми веществами
XeF2 фторирует Mn, W, Nb, Sb, Sn, Ti, S, P, Te, Ge, Si до высших фторидов в интервале температур от −10 до +30 °C. Нагревание реакционной смеси до 50 °C приводит к взаимодействию дифторида ксенона с оксидами и солями многих металлов.
В твердофазной системе при нагревании окисляет Ce, Pr и Tb до тетрафторидов.
Реакции окисления
Водный раствор дифторида окисляет броматы до перброматов:
Окислительное фторирование
Пример окислительного фторирования для теллур-органического соединения (тут атом теллура меняет степень окисления от +4 до +6):
Восстановительное фторирование
Пример восстановительного фторирования (тут атом хрома меняет степень окисления от +6 до +5):
Фторирование ароматических соединений
Фторирование ароматических соединений идёт по механизму электрофильного замещения:
![Фторид ксенона II]()
При этом возможно и восстановительное фторирование (за счет растворителя):
![Фторид ксенона II]()
Фторирование непредельных соединений
![Фторид ксенона II]()
Достаточно селективно можно проводить фторирование диеновых производных в 1,2-положения: .
Фторирующее декарбоксилирование
Дифторид ксенона декарбоксилирует карбоновые кислоты, при этом образуются соответствующие фторалканы:
Ксенон, свойства атома, химические и физические свойства.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
131,293(6) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6
Атом и молекула ксенона. Формула ксенона. Строение атома ксенона:
Ксенон – неметалл. Относится к группе инертных (благородных) газов.
Ксенон обозначается символом Xe.
Как простое вещество ксенон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула ксенона одноатомна.
Химическая формула ксенона Xe.
Электронная конфигурация атома ксенона 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 . Потенциал ионизации (первый электрон) атома ксенона равен 1170,35 кДж/моль (12,1298436(15) эВ).
Строение атома ксенона. Атом ксенона состоит из положительно заряженного ядра (+54), вокруг которого по пяти оболочкам движется 54 электрона. При этом 46 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку ксенон расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома ксенона на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома ксенона состоит из 54 протонов и 77 нейтронов. Ксенон относится к элементам p-семейства.
Радиус атома ксенона (вычисленный) составляет 108 пм.
Атомная масса атома ксенона составляет 131,293(6) а. е. м.
Содержание ксенона в земной коре составляет 2,0×10 -9 %, в морской воде и океане – 5,0×10 -10 %.
Читайте также: