Какой из перечисленных галогенов может вступать в реакцию с ксеноном
К данным химическим элементам относят элементы VII группы главной подгруппы – фтор, хлор, бром, йод.
Отличительными особенностями галогенов является резко выраженные свойства неметаллов, или металлоидов. На внешнем энергетическом уровне у данных элементов семь электронов, то есть он считается не завершенным. В связи с этим они могут активно присоединять электроны для его завершения.

Рассмотрим химические свойства галогенов на определенных примерах.
-
При взаимодействии с металлами галогены образуют соли. Реакции происходят в зависимости от степени активности того или иного элемента.
Фтор, как сильнейший окислитель, реагирует с металлами в нормальных условиях, а при высоких температурах способен взаимодействовать даже с неактивными металлами – серебром, золотом, платиной. Алюминий и цинк способны гореть в атмосфере фтора.
Медь, взятая в виде пучка тонкой проволоки и предварительно нагретая на воздухе, при погружении в хлор раскаляется и сгорает, наполняя колбу бурым дымом. Бурый дым представляет собой частички хлорной меди.
Йод также вступает в реакции с металлами. Если растертый в ступке йод смешать с порошком алюминия, то через некоторое время сама собой начнется реакция соединения. Активизируется процесс в присутствии воды.
Реакция сопровождается появлением пламени. Продукт реакции – йодистый алюминий получается в виде тяжелого дыма, окрашенного примешивающимися к нему парами йода в фиолетовый цвет.
-
Галогены могут взаимодействовать с щелочными растворами. Реакции протекают по-разному при высоких и низких температурах. При взаимодействии хлора со щелочами на холоде образуется смесь хлоридов и гипохлоритов.
Cl2 + 2KOH → KCl + KClO + H2O
В горячем растворе щелочи происходит реакция, при которой образуются хлорид калия и хлорат калия или бертоллетова соль.
Взаимодействие хлора с водой протекает в два этапа. Во-первых, хлор реагирует с водой с образованием хлорной и хлорноватистой кислоты.
Тренажер задания 31 из ЕГЭ по химии галогенов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии галогенов с текстовыми решениями и ответами.
- Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.

- Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.

- Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
- Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
- При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.

7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
HI + NaOH = NaI + H2O
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску. Напишите уравнения описанных реакций.
NaClO + 2HI = NaCl + I2 + H2O
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.

10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.

11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
Галогены (греч. hals - соль + genes - рождающий) - химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

- F - 2s 2 2p 5
- Cl - 3s 2 3p 5
- Br - 4s 2 4p 5
- I - 5s 2 5p 5
- At - 6s 2 6p 5
Природные соединения
- NaCl - галит (каменная соль)
- CaF2 - флюорит, плавиковый шпат
- NaCl*KCl - сильвинит
- 3Ca3(PO4)2*CaF2 - фторапатит
- MgCl2*6H2O - бишофит
- KCl*MgCl2*6H2O - карналлит

Простые вещества - F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте - HF - был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.

В лабораторных условиях галогены могут быть получены следующими реакциями.
-
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ;)
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром - F - )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод - Br - )
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду - смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами - только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
- HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl - хлороводород (газ), соляная кислота (жидкость)
- HBr - бромоводород, бромоводородная кислота
- HI - йодоводород, йодоводородная кислота
- HAt - астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI - газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF - является слабой кислотой, HCl, HBr, HI - сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)

Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
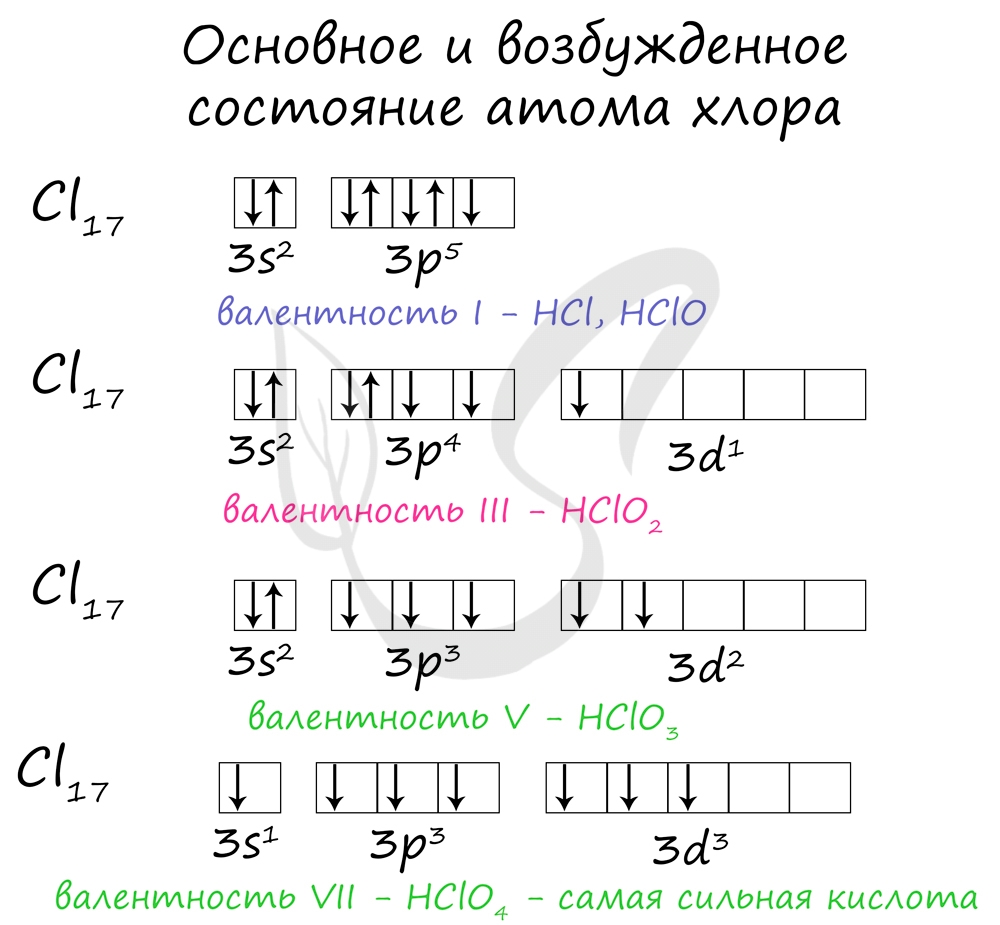
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее - оксиды и кислоты.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO - бромноватистая кислота (соли гипобромиты), HIO - иодноватистая кислота (соли гипоиодиты).
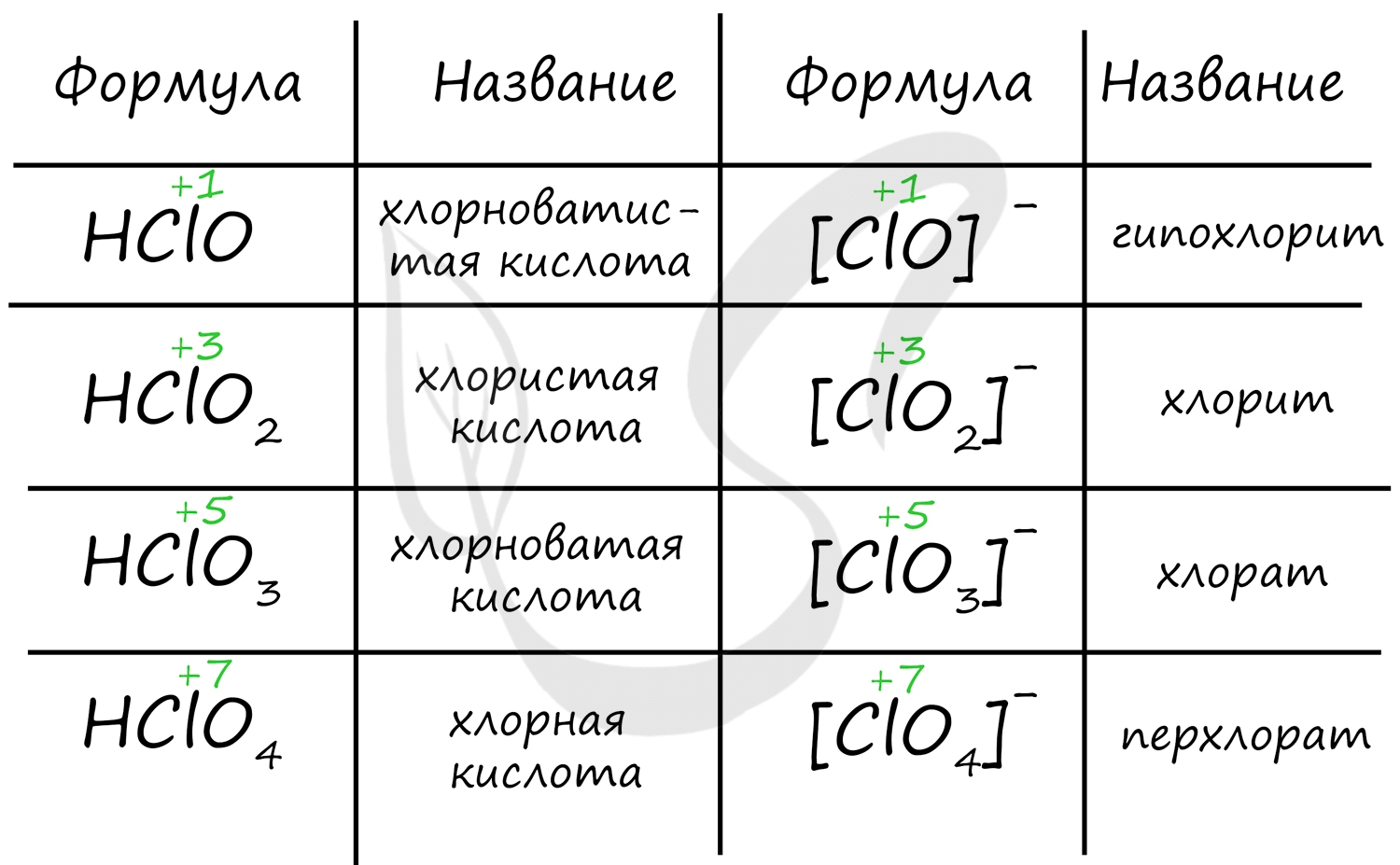
HIO3 - иодноватая кислота (соли иодаты), HBrO3 - бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.

В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.

Хлористая кислота может быть получена из собственных солей - хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе - хлорная кислота - может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.

Химические свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная - к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
И кислоты, и их соли разлагаются схожим образом.

KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
Бромоводородная кислота, сильная Бромная кислота, сильная Бромистая кислота, слабая Бромноватистая, слабая
HBrO2 - бромистая кислота, слабая
Хлорная кислота, сильная Хлорноватая кислота, сильная Хлористая кислота, слабая Хлорноватистая кислота, слабая
Читайте также:

